從醫(yī)藥研發新政視(shì)角看醫(yī)藥産業趨勢
來(lái)源:解驕陽 浏覽人(rén)數(shù):17211 時(shí)間(jiān):2017/09/18
随着我國經濟不斷發展、社會(huì)老齡化程度變高(gāo)、疾病的慢性化特征越來(lái)越明(míng)顯,人(rén)民群衆對醫(yī)療健康的關注不斷增強,中國醫(yī)藥行(xíng)業的需求持續增長。人(rén)的一生(shēng)避免不了看病吃(chī)藥,我們每個(gè)人(rén)都受益醫(yī)藥産業的發展。從全球的發展趨勢可(kě)以看到,絕大(dà)多(duō)數(shù)國家(jiā)的醫(yī)藥衛生(shēng)費用支出占GDP的比例都是不斷提高(gāo)的。醫(yī)藥市場(chǎng)的需求不僅随着各國經濟發展而表現出持續繁榮,而且将超越經濟發展速度并呈現出開(kāi)放式增長的特點。
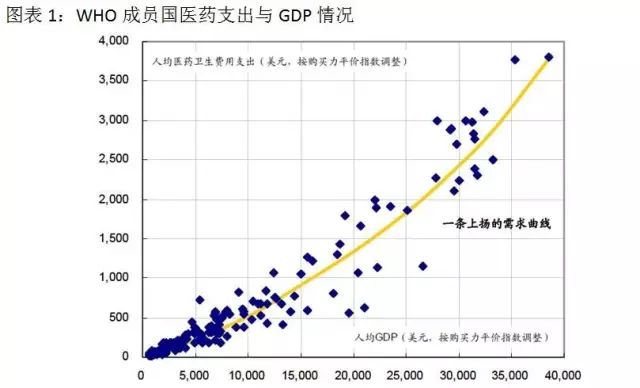
在長期看好醫(yī)藥産業發展的同時(shí),我們也應該注意醫(yī)藥行(xíng)業的特殊性。醫(yī)藥企業的下遊主要是處于強勢地位的醫(yī)院等醫(yī)療機構,醫(yī)院和(hé)醫(yī)生(shēng)很(hěn)大(dà)程度上(shàng)決定着患者最終醫(yī)藥消費。藥品市場(chǎng)本身是非常市場(chǎng)化的,但(dàn)醫(yī)藥企業所面對的是非市場(chǎng)化的實體(tǐ)——強大(dà)的産業監管系統和(hé)支付方,政策對産業影(yǐng)響就變得(de)至關重要。同時(shí)研發又是醫(yī)藥企業長期持續發展的核心競争力,那(nà)麽從與醫(yī)藥研發相關的新政策這個(gè)視(shì)角切入能較好的前瞻未來(lái)産業趨勢。
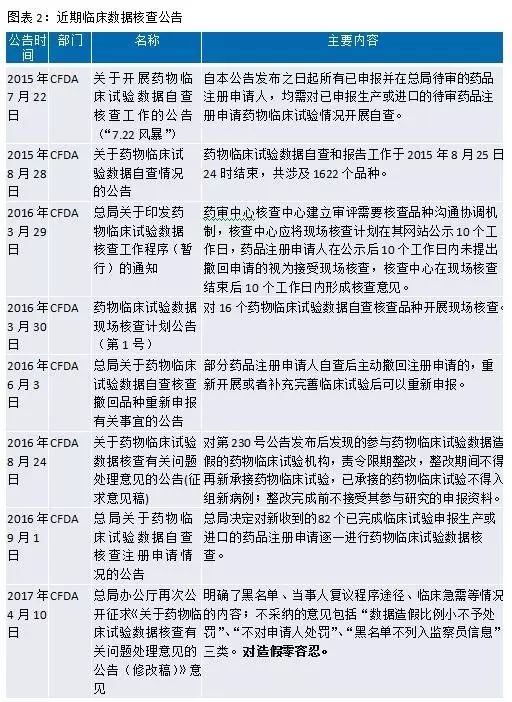
自2015年7月22日CFDA發布的“對1622個(gè)已申報生(shēng)産或進口的待審藥品注冊申請(qǐng)開(kāi)展藥物臨床試驗數(shù)據核查”文件至今,國務院、CFDA、CDE發布了一系列重磅政策,從藥品研發端鼓勵我國醫(yī)藥企業進行(xíng)創新與國際接軌,這必将給産業帶來(lái)深遠影(yǐng)響和(hé)很(hěn)好的投資機會(huì)。這些(xiē)政策主要包括臨床數(shù)據核查、集中審評、優先審評審批、仿制(zhì)藥一緻性評價、化學藥品注冊分類改革和(hé)上(shàng)市許可(kě)持有(yǒu)人(rén)試點等。
臨床試驗數(shù)據自查核查是新政開(kāi)端,目前已經常态化。臨床數(shù)據核查按照“最嚴謹标準、最嚴格監管、最嚴厲處罰、最嚴肅問責”的要求,建立長效工作(zuò)機制(zhì),确保藥物臨床試驗數(shù)據真實可(kě)靠。數(shù)據核查開(kāi)展的初衷是在審藥品大(dà)量積壓,阻礙了藥品審批進度。此外,國家(jiā)開(kāi)展臨床數(shù)據核查,可(kě)以獲得(de)更有(yǒu)效真實的臨床數(shù)據,有(yǒu)利于患者和(hé)整個(gè)醫(yī)藥産業的長遠發展。從目前的效果來(lái)看,臨床數(shù)據核查帶來(lái)大(dà)規模的撤回緩解了積壓,将壓縮仿制(zhì)藥的低(dī)水(shuǐ)平仿制(zhì),能使審評重點轉移到創新上(shàng),優化資源配置。
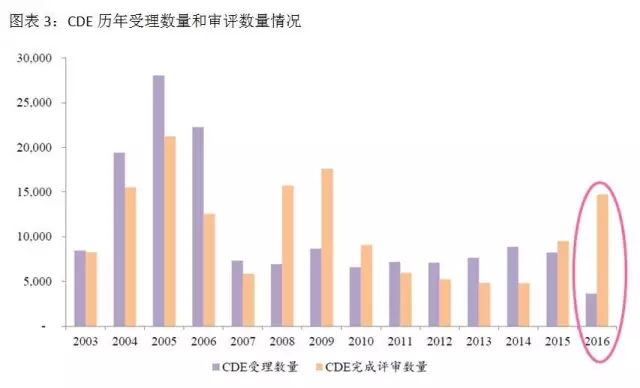
2016年2月26日,CFDA發布《關于解決藥品注冊申請(qǐng)積壓實行(xíng)優先審評審批的意見》,把重大(dà)疾病用藥、創新藥、優質仿制(zhì)藥、市場(chǎng)短(duǎn)缺藥物納入優先審評審批的範疇。在藥品審評審批改革前,有(yǒu)近一半的時(shí)間(jiān)是在CDE排隊等待。
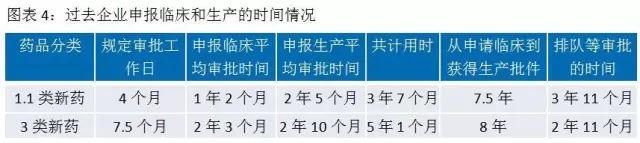
開(kāi)展優先審評審批以後,納入優先審評審批序列的藥品,CDE每隔一個(gè)月會(huì)發布一批品種名單,列入優先審評的申請(qǐng)不再排隊直接啓動審評。其中對于新藥的臨床試驗申請(qǐng)和(hé)生(shēng)産注冊申請(qǐng)的各個(gè)環節所需時(shí)間(jiān)進行(xíng)了詳細規定,新藥的審評審批時(shí)間(jiān)得(de)以大(dà)幅壓縮。

由于創新藥的臨床普遍比仿制(zhì)藥更規範和(hé)受益于優先審評審批政策,近兩年批準臨床的批件創曆史新高(gāo)。1.1類新藥審批大(dà)量增加,新藥放量趨勢開(kāi)始出現。未來(lái)會(huì)有(yǒu)更多(duō)的創新藥和(hé)優質仿制(zhì)藥受益于優先審評審批,促進我國醫(yī)藥企業的創新升級。
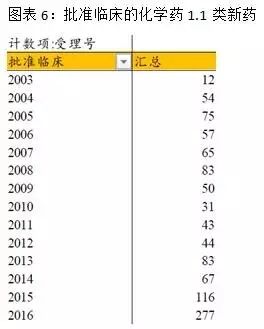
國內(nèi)已經有(yǒu)部分藥企的産品通(tōng)過FDA、歐盟的質量認證,近年來(lái)國內(nèi)的仿制(zhì)藥水(shuǐ)平受到國際上(shàng)的一定認可(kě)。但(dàn)是總體(tǐ)來(lái)說,國內(nèi)的化藥仿制(zhì)藥與原研産品在産品有(yǒu)效性、安全性上(shàng)還(hái)有(yǒu)一定差距。從深化醫(yī)改和(hé)醫(yī)保控費的趨勢下,進口替代勢在必行(xíng),而一緻性評價又是實現進口替代的藥品質量保證。近期CFDA關于一緻性評價政策的密集出台,最新的是2017年9月4日CDE發布《關于公開(kāi)征求<中國上(shàng)市藥品目錄集>框架意見的通(tōng)知》,作(zuò)為(wèi)落實一緻性評價工作(zuò)的重要舉措,這一中國版“OrangeBook”的制(zhì)定進入起步階段。
一緻性評價對患者而言能保證用藥安全,降低(dī)醫(yī)療費用;對制(zhì)藥企業而言,能提高(gāo)用藥質量,減少(shǎo)無序競争;對醫(yī)藥行(xíng)業而言,能提高(gāo)整體(tǐ)水(shuǐ)平,具有(yǒu)國際競争力。此外,一緻性評價在支付端能享有(yǒu)招标單獨分組、按品種設定醫(yī)保支付标準、優先選用通(tōng)過品種等政策扶持。
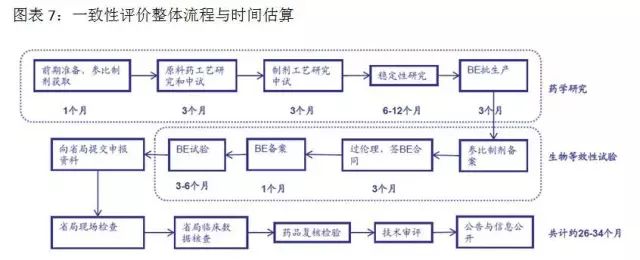
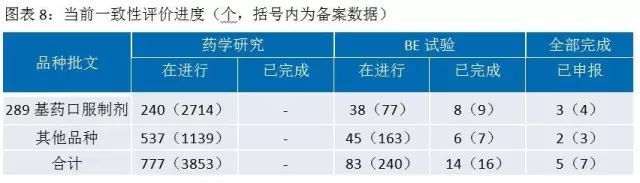
一緻性評價研究耗時(shí)時(shí)間(jiān)長、投入多(duō)、難度大(dà)。對于企業來(lái)說,難度主要體(tǐ)現在:參比制(zhì)劑的确定與獲取、處方工藝的研究、生(shēng)物等效試驗的不确定性。一個(gè)品種完成一緻性評價,費用約500-800萬元,耗時(shí)32-36個(gè)月。其中藥學研究和(hé)二次開(kāi)發花(huā)費約占一半,生(shēng)物等效性試驗花(huā)費約占一半。資金充裕、研發實力雄厚的大(dà)型藥企會(huì)有(yǒu)選擇的進行(xíng)一緻性評價研究,中小(xiǎo)型制(zhì)藥企業将主要精力用于市場(chǎng)領先的、收入占比大(dà)的品種優先一緻性評價工作(zuò),競争力弱的相關品種直接放棄。目前一緻性評價進度低(dī)于預期,但(dàn)從長期來(lái)看,必将促進行(xíng)業的健康發展。
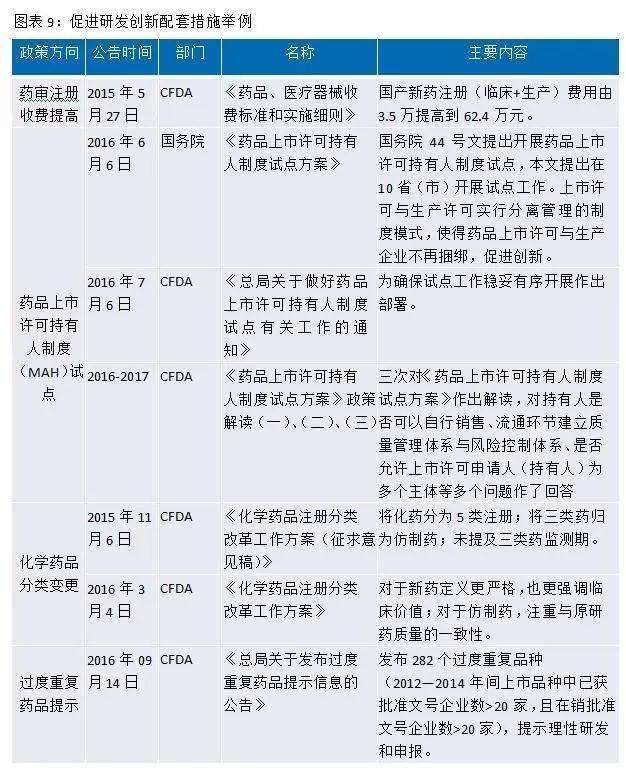
此外,國務院、CFDA等還(hái)出台了許多(duō)配套政策來(lái)提高(gāo)我國藥品質量,促進醫(yī)藥行(xíng)業研發創新。例如MAH(藥品上(shàng)市許可(kě)持有(yǒu)人(rén)制(zhì)度)表明(míng)藥品所有(yǒu)權屬于研發公司或者個(gè)人(rén),國家(jiā)通(tōng)過這個(gè)制(zhì)度,鼓勵創新,激勵研發人(rén)員,有(yǒu)利于創新産品開(kāi)發;對化藥注冊分類進行(xíng)改革,定義更嚴格,更強調臨床價值,鼓勵真正的創新等。
從政策的不斷出台和(hé)落地來(lái)看,國家(jiā)對醫(yī)藥研發端的創新升級可(kě)謂非常重視(shì),速度和(hé)力度超越市場(chǎng)預期。新的政策給醫(yī)藥行(xíng)業即帶來(lái)挑戰又帶來(lái)機會(huì),減少(shǎo)了注冊積壓,加快了審評,加快了與國際接軌,鼓勵優勝劣汰,鼓勵創新。當今中國醫(yī)藥行(xíng)業正處于大(dà)的變革,研發越來(lái)越成為(wèi)醫(yī)藥企業的核心。從世界制(zhì)藥發展史來(lái)看,世界級大(dà)型制(zhì)藥企業基本上(shàng)都是研發型藥企,多(duō)來(lái)自藥品監管相對寬松的國家(jiā),比較從容的市場(chǎng)環境使制(zhì)藥企業能夠以研發為(wèi)根本追求企業的長期可(kě)持續發展。1891年美國默克成立,從默默無名的小(xiǎo)公司開(kāi)始一步步成為(wèi)世界制(zhì)藥巨頭,其發展曆程值得(de)我們去思考和(hé)學習。《制(zhì)藥世家(jiā)默克》一書(shū)中也曾寫到“制(zhì)藥業是那(nà)麽的反複無常。一切取決于下一步的試驗結果,或者是食品和(hé)藥品管理(lǐ)局的一道(dào)命令,或者是默克新的降脂藥或宮頸癌疫苗。但(dàn)公司堅信,公司在2003年的利潤增長會(huì)重新達到兩位數(shù)。而最關鍵的是,默克實驗室是否聚集了具有(yǒu)研發能力的精英,以及公司是否有(yǒu)東山(shān)再起的激情,不管怎樣,研發和(hé)人(rén)還(hái)是制(zhì)藥企業的根本所在。”醫(yī)藥企業雖然永遠受到行(xíng)業政策和(hé)監管的影(yǐng)響,但(dàn)那(nà)些(xiē)立志(zhì)要滿足人(rén)類對健康和(hé)生(shēng)命無止境追求的優秀醫(yī)藥企業們,必将通(tōng)過不斷研發創新來(lái)發展壯大(dà)并改變世界。縱觀海外發達市場(chǎng)走過的道(dào)路,有(yǒu)理(lǐ)由相信我們正走在一條正确的道(dào)路上(shàng),我國優秀醫(yī)藥企業将抓住産業的變革,立足研發,走向世界,改變人(rén)類。
